نگاه تخصصی به علت مرگ زودهنگام (EMS) در میگوها

تلفات انبوه میگو
هنگام خرید میگو از یک کارخانه هچری در حدود پنج ساعت با ماشین، تجربه بدی داشتم. این بارتمام ۱۰۰۰۰۰ لارو پس از ۴۸ ساعت مرده بودند. چند نمونه برای تجزیه و تحلیل حفظ شد. چند هفته بعد، موفق شدم دسته دوم میگو را از یک هچری متفاوت خریداری کنم و پس از یک دوره کامل، متوجه مرگ و میر منظم ۵ تا ۱۰ درصدی شدم. هر روز به مدت پنج روز، قبل از اینکه همه میگوها تلف شوند، میگوهای بیمار را خارج کرده و در مخزن دیگری در یک دهم چگالی قرار دادم.
بار دیگر، اکثر مرگ و میرها متوقف شد و میگوها با سرعتی سریعتر از حد معمول شروع به رشد کردند، احتمالاً به دلیل کاهش تراکم. این میزان مرگ و میر بسیار شبیه چیزی است که قبلاً با ماهی تیلاپیا تجربه کردم. استثنا در اینجا این بود که تلفات میگو با نرخ بسیار پایین، کمتر از ۱ درصد در روز، ادامه یافت. من از علت مرگ و میر پس از لارو مطمئن نبودم. مزرعه من در پاناما برای همه پاتوژن های شناخته شده میگو در اکتبر سال قبل توسط یک آزمایشگاه تایید شده بیماری میگو آزمایش شده بود. نمونههای میگوی گرفتهشده از هر استخر و همه میگوها برای همه بیماریهای میگو منفی بود، به استثنای ویروس نکروز زیرپوستی و خونساز عفونی (IHHN) که برای دههها در پاناما بومی بوده و مشخص نیست که هیچ مشکلی ایجاد کند.
علائم بالینی میگوی وانامی به طور تجربی با سه جدایه مختلف V. parahaemolyticus آلوده شده است. میگوی سمت چپ رنگ طبیعی را در هپاتوپانکراس نشان می دهد و میگوی سمت راست تغییر رنگ رنگ پریده روی هپاتوپانکراس و معده خالی را نشان می دهد که نشانه های معمول میگوهای آلوده به AHPND است. © با پروفسور دی وی لایتنر
در طول فوریه ۲۰۲۱، من با Autoridad de Recursos de Acuticos de Panama (ARAP) تماس گرفتم تا آنها بیایند و نمونههایی را برای شناسایی بیماریهای موجود جمعآوری کنند. من می دانستم که بیماری نکروز حاد کبدی (AHPND) – که به عنوان سندرم مرگ زودرس (EMS) نیز شناخته می شود – در پاناما شایع است، اما انتظار نداشتم هچری ها آگاهانه به من لاروهای بیمار را بفروشند. من ۱۰ میگوی دیگر در دو اندازه را برای تجزیه و تحلیل جمع آوری کردم و بعداً توسط یک آزمایشگاه تایید شده بیماری میگو مشکل AHPND بودن آن تایید شد. من لاروهای پست لارو را از هچری در پاناما به مدت هفت سال از دوره ۲۰۱۰ تا ۲۰۱۷ خریداری کرده بودم، زمانی که آنها به عنوان عاری از پاتوژن خاص (SPF) طبقه بندی شده بودند و هرگز برای بیش از ۲۰ محموله مشکل بیماری نداشتم. در واقع، من در طول ۲۵ سال تجربه خود در آبزی پروری در پنج کشور هیچ مشکلی با بیماری نداشتم، زیرا سیستم های من همگی امنیت زیستی داشتند. با این حال، این بار بسیار متفاوت بود، هچرهای پاناما قطعا تغییر کرده بودند.
وقتی به شباهتهای دیگر گزارشهای دست اول درباره AHPND نگاه میکردم، گزارشهایی پیدا کردم که نشان میدهد ۸۰ درصد مرگومیر معمولی سندرم مرگومیر زودرس (EMS) است و پس از لاروهای هچریهای مختلف، نرخهای بقای متفاوتی داشتند. معروف است که کارخانه های هچری دو خط میگو را به طور معمول تولید می کنند – یکی با رشد بالا و دیگری مقاوم به بیماری. گونه ای که می تواند در یک سیستم کاملاً ایمن زیستی زنده بماند و سریع رشد کند و سویه دیگری که در حوضچه ها ذخیره می شود و انتظار می رود در برابر پاتوژن های مختلف موجود در آنجا زنده بماند. در این مرحله من به مقامات جهانی در مورد بیماری میگو مراجعه کردم. من با مدیر آزمایشگاه آسیب شناسی آبزی پروری در دانشگاه آریزونا، دکتر آرون دار، تماس گرفتم و موفق شدم با او و همکارش، دکتر فرناندو آرانگورن مصاحبه ای انجام دهم.
به گفته دکتر Dhar، EMS در ابتدا با سویه خاصی از باکتری Vibrio parahaemolyticus مرتبط بود. بیماری مرتبط با این باکتری ابتدا در سال ۲۰۰۹ در چین ظاهر شد و به طور پیوسته در سراسر آسیا و سپس به قاره آمریکا گسترش یافت. ژن سم باینری که باعث تولید سم می شود پلاستیک و متحرک است و می تواند در اطراف ژنوم گونه های ویبریو حرکت کند. همچنین عناصر ژنتیکی قابل انتقالی در کنار ژن سمی دوتایی وجود دارد که احتمالاً در بین گونههای ویبریو تحرک بیشتری دارد. در سطوح کم باکتری در آب، سطوح کمتری از سموم تولید می شود
این باکتری یک سم دوتایی آزاد می کند که باعث آسیب یا مرگ بافت (نکروز) به هپاتوپانکراس میگو می شود و منجر به مرگ و میر می شود. به گفته دکتر دار، چیزی که این باکتریهای ویبریو را از سایر باکتریهای ویبریو که معمولاً در محیطهای آبی یافت میشوند جدا میکند، یک ژن سمی دوتایی است که در کد ژنتیکی یافت میشود و یک سم کشنده تولید میکند. جالب توجه است، گاهی اوقات Vibrio عامل AHPND ممکن است در یک سیستم وجود داشته باشد اما ممکن است سم کافی برای ایجاد مرگ و میر در میگو ترشح نکند. بنابراین ژن تولید کننده سم از کجا آمده است؟
دکتر دار گفت: “هیچ کس واقعا نمی داند که این ژن از کجا آمده است، این ژن سمی به طور معمول در ژنوم باکتری ویبریو یافت نمی شود.” اخیراً ژنی که سمیت ایجاد می کند در سایر گونه های ویبریو پیدا شده است. آنها حتی یک سویه Vibrio parahaemolyticus را مشخص کردهاند که حامل ژنهایی است که ژن سم باینری را کد میکند، اما سم را تولید نمیکند (که در طبیعت پروتئین است)، این ماده سمی را به همان میزان تولید نمیکند که باعث چنین نرخهای سریع و بالایی از مرگ و میر میشود.
ژن سم دوتایی که باعث تولید سم می شود پلاستیک و متحرک است و می تواند در اطراف ژنوم گونه های ویبریو حرکت کند. همچنین عناصر ژنتیکی قابل انتقالی در کنار ژن سمی دوتایی وجود دارد که احتمالاً در بین گونههای ویبریو متحرکتر میشود.
دکتر آرانگورن افزود: «در سطوح کم باکتری در آب، سطوح کمتری از سموم تولید میشود».
به گفته دکتر آرانگورن، به نظر می رسد که سنجش حد نصاب تولید سم را آغاز می کند، زیرا سطح باکتری ها به سطح معینی افزایش می یابد، باکتری ها به عنوان یک جمعیت به طور کلی سیگنال آزادسازی سموم را می دهند. در سطح باکتریایی پایین، احتمالاً ژن سم دوتایی به اندازه کافی فعال نمی شود و در نتیجه سم کمتری تولید می شود. این به معنای عدم مرگ و میر است. به طور معمول، هنگامی که این باکتری در یک سیستم آبزی پروری فشرده وجود دارد، در عرض ۱۲ ساعت مرگ و میر وجود دارد. دکتر آرانگورن گفت که EMS در برخی از کشورهای آمریکای لاتین وجود دارد و فقط باعث مرگ و میر مزمن و نه حاد می شود. این احتمال وجود دارد که میگو نسبت به باکتری ویبریو مقاومت/تحمل ایجاد کرده باشد، به طوری که این وضعیت منجر به نکروز هپاتوپانکراس نمی شود.
محتمل ترین راه ورود این بیماری به مزارع از طریق میگوهای زنده پس از لارو یا مولدین است. وی افزود: تنها راه واقعی برای پیشگیری از این بیماری غربالگری تمامی لاروهای ورودی با بافت شناسی و تجزیه و تحلیل PCR و انجام اقدامات قرنطینه ای سخت است.
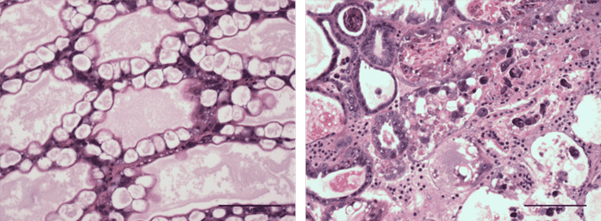
بافت شناسی H&E (مایر-بنت هماتوکسیلین و ائوزین-فلوکسین) یک میگو سالم (سمت چپ) و یک میگوی آلوده به AHPND (راست) SPF که عفونت فاز حاد را نشان می دهد. در حیوان آلوده (پانل سمت راست)، ریزش سلول های اپیتلیال در لومن توبول کبدی پانکراس، منجر به فروپاشی توبول می شود. میله های مقیاس = ۱۰۰ میکرومتر. (برای بزرگنمایی روی تصویر کلیک کنید).
استفاده از توصیه های کارشناسان
بنابراین، چگونه میگوهای پس از لارو در هچری ها زنده می مانند و پس از قرار گرفتن در تأسیسات ایمنی زیستی که طی سالیان متمادی آزمایش شده و بدون بیماری هستند، به سرعت می میرند؟
از آنجایی که کارخانه های هچری میگو همیشه در مورد پروتکل ها و تکنیک های مورد استفاده برای تولید لاروهای پس از لارو صحبت می کنند، تعیین دقیق اینکه در مورد من چه اتفاقی افتاده دشوار بود. با این حال، ارائه یک سناریوی بسیار قابل قبول دشوار نیست – هچری ها می توانستند در تبادل شدید آب با آب استریل، پروبیوتیک ها، آنتی بیوتیک ها و مواد محرک سیستم ایمنی گران قیمت در خوراک ها شرکت کنند که به لاروهای پست اجازه می داد تا تعداد کمتر ویبریو را تحمل کنند. عدم وجود مقادیر بیش از حد سموم تولید شده از طریق سنجش حد نصاب. هنگامی که لاروهای پست لارو وارد “جنگل” یک سیستم فشرده با مواد جامد بالا، نیتروژن سطح پایین و محیط “نوع ویبریو” مطلوب می شوند، به سرعت می میرند.
آیا درمانی وجود دارد؟
Dhar می گوید: «هیچ درمانی برای AHPND وجود ندارد، هنگامی که بیماری در یک مزرعه معرفی شود، میگوهایی که قبلاً در معرض این بیماری قرار نگرفته اند، ممکن است مرگ و میر بالایی داشته باشند، به خصوص زمانی که شرایط برای رشد ویبریو مساعد باشد. به گفته هر دوی این متخصصان بیماری میگو، تنها راه حل برای AHPND این است که با امنیت زیستی کامل از نو شروع کنید یا سعی کنید میگوهایی را که توانایی ذاتی برای زنده ماندن از عفونت باکتریایی دارند، تکثیر کنید. میگوهایی که به طور معمول سریع رشد می کنند مقاومت باکتریایی ندارند، بنابراین انتخاب برای بقا به معنای نرخ رشد کمتر است. برخلاف اکثر ویروسها، این باکتریها میتوانند برای مدت طولانی بدون میزبان زنده بمانند، که ریشهکنی آنها را بسیار سختتر از ویروسها میکند.
یکی دیگر از راه های ممکن برای مقابله با باکتری [ویبریو] افزودن اسیدهای آلی به غذاها برای تولید اسیدیته بیشتر (PH پایین تر) در دستگاه گوارش است تا توانایی باکتری ها برای رشد و تکثیر در میگو محدود شود. بنابراین، در اصل، با افزودن اسیدهای آلی به خوراک، ممکن است توانایی مقاومت در برابر عفونت باکتریایی را افزایش دهد.
دکتر آرانگورن میگوید که در آزمایشهایی در اکوادور نشان داده شده است که افزودن یک باکتری مشابه دیگر، که جایگاه اکولوژیکی مشابهی را در سیستم اشغال میکند، ممکن است از باکتریهای عفونی سبقت بگیرد و این میتواند احتمال ابتلا به میگو را محدود کند.
یکی دیگر از راه های ممکن برای مقابله با باکتری [ویبریو] افزودن اسیدهای آلی به خوراک برای تولید اسیدیته بیشتر (PH پایین تر) در دستگاه گوارش است، به طوری که توانایی باکتری ها برای رشد و تولید مثل در میگو را محدود می کند. . بنابراین، در اصل، با افزودن اسیدهای آلی به خوراک، ممکن است توانایی مقاومت در برابر عفونت باکتریایی را افزایش دهد.
این هچری ها چه زمانی بهبود می یابند؟ احتمالاً برای سالها نه – هنگامی که هچریها به این بزرگی عفونت مبتلا شوند، اجزا باید کاملاً جدا شوند، استریل شوند، خشک شوند و دوباره ساخته شوند. مولدین باید برای مقاومت در برابر بیماری انتخاب شوند و در صورت امکان ضد عفونی و برای نسلها پرورش داده شوند تا زمانی که یک سویه مقاوم به باکتری ایجاد شود تا بتواند به اندازه کافی از AHPND زنده بماند. پس از انجام این کار، دریافت مجدد گواهینامه برای وضعیت SPF به این راحتی انجام نخواهد شد. فراتر از این، کارخانه های هچری باید اعتماد را در میان کشاورزان بازسازی کنند.
۲۶ March 2021